Hast du zuhause schon mal ein richtiges Chemieexperiment mit beeindruckendem Ausgang durchgeführt? Wenn ich dir jetzt auch noch sage, dass es ganz einfach, völlig ungefährlich und zudem noch nützlich ist – bist du dann dabei? Dann leg dir am besten gleich alle deine oxidierten Schmuckstücke, dein Besteck oder sonstige Gegenstände aus Silber bereit. Denn ich zeige dir nun gleich, wie du diese wieder zum Glänzen bringst.
Ich mag das Material Silber sehr gerne, doch leider läuft es gerne mal schwarz an. Besonders Schmuck, der mit mit Kosmetika in Berührung kommt oder offen an der Luft liegt, oder Besteck, mit dem gewisse Nahrungsmittel (beispielsweise Eier) gegessen werden, oxidieren schnell und stark.
Oberflächliche Flecken können gut mit einem Tuch abgerieben werden. Um Silber zu reinigen, das in Vertiefungen oxidiert ist, etwa Schmuck oder graviertes Besteck, kommen meist aggressive Reinigungsmittel zum Einsatz. Abgesehen davon, dass solche Reinigungsmittel sowohl für dich als auch für die Natur schädlich sind, haben beide genannte Reinigungsmethoden einen Nachteil. Sie entfernen das oxidierte Material. Wird das oft gemacht, schwindet das Silber merklich. Bei der hier vorgestellten Methode wird kein Material abgetragen, sondern der chemische Prozess, der zum Rost geführt hat, umgedreht.
Redox-Reaktionen
Bevor wir das Experiment durchführen, erkläre ich dir hier, was eigentlich chemisch passiert. Wenn du nicht daran interessiert bist, WARUM dein Schmuck wieder glänzt, sondern du nur wissen willst, WIE du das machst, dann springe zum Abschnitt “Silber reinigen” unten.
Die dunkle, fast schwarze Schicht auf dem Silber, die wir entfernen wollen, heisst Oxidationsschicht. Das ist kein Zufall, denn es handelt sich um Silber, welches oxidiert ist. Die Bezeichnung leitet sich vom griechischen Wort oxygóno (οξυγόνο) für Sauerstoff ab. Historisch nannte man die Vereinigung von Elementen oder chemischen Verbindungen mit Sauerstoff Oxidation. Doch es können ähnliche Vereinigungen mit anderen Elementen als Sauerstoff entstehen, beispielsweise mit Schwefel. Das ist wenig überraschend, denn Schwefelatome haben gleich viele Elektronen in der äussersten Schale wie Sauerstoffatome und reagieren somit ähnlich. Aber ganz so tief wollen wir jetzt nicht in die Chemie einsteigen 😉
Heute bezeichnet Oxidation eine Reaktion, bei der ein Atom oder Ion Elektronen abgibt.
Gleichzeitig muss jemand diese Elektronen aufnehmen. Eine solche Reaktion, bei der ein Atom oder ein Ion Elektronen aufnimmt, heisst Reduktion.
Diese beiden Reaktionen passieren immer gleichzeitig. Man spricht deshalb von Redox-Reaktionen (REDuktions-OXidations-Reaktionen).
Oxidation von Silber
Wird Silber oxidiert, reagiert es zu einer Silber-Schwefel-Verbindung, dem Silbersulfid. Gleichzeitig passiert natürlich eine Reduktion.
Konkret passiert folgendes:
In der Luft gibt es kleine Spuren Schwefelwasserstoff und auch Kosmetika oder Eier enthalten Schwefel (das ist übrigens der Grund für den leicht fauligen Geruch von Eiern). Kommt dieser Schwefel nun mit dem Silber in Berührung, gibt das Silber Elektronen an ebenfalls vorhandenen Sauerstoff ab. Die Schwefelatome im Schwefelwasserstoff lassen den Wasserstoff ohne Elektronen stehen und verbinden sich mit dem Silber. Der Wasserstoff und der Sauerstoff verbinden sich zu Wasser.
Als Formel sieht das so aus, wobei die Elemente mit den folgenden Symbolen beschreiben werden: Ag=Silber, O=Sauerstoff, H=Wasserstoff, S=Schwefel, e-=Elektron.
Redox-Reaktion

Die ganze Reaktion des Silbers mit dem Schwefelwasserstoff

Silber reinigen
Kommen wir nun zum praktischen Teil. In diesem Abschnitt erkläre ich dir, wie du die dunkle Oxidationsschicht auf dem Silber loswirst.


Für das Experiment wird nur eine Pfanne, ein Stück Aluminiumfolie, etwas Kochsalz und Wasser benötigt.
Erwärme in der Pfanne (es sollte keine Aluminiumpfanne sein) so viel Wasser, dass die Silbergegenstände gut mit Wasser bedeckt sind, wenn du sie dann hineingeben wirst. Koche das Wasser auf. Danach legst du ein Stück Aluminiumfole in die Pfanne und gibst Salz dazu. Es braucht nicht Unmengen Salz, aber es lohnt sich nicht, allzu sparsam zu sein. Schliesslich kommt das Silber hinein, und zwar so, dass es die Aluminiumfolie berührt.
Nun hatte ich, bevor ich das Experiment durchführte, gelesen, dass es etwa drei Minuten geht, bis das Silber wieder glänzt. Manchmal gehe es auch ganz schnell und es sei schon nach 30 Sekunden wieder gut. Ich habe also zu Beginn leider nicht so genau hingeschaut. Ich habe mein Schmuckstück hineingegeben, kurz den Blick abgewandt, und als ich wieder in die Pfanne schaute, war der Spuk schon vorbei. Rechne also damit, dass die Reaktion auch nur wenige Sekunden dauern kann und wende den Blick nicht ab, wenn du den spannenden Teil nicht wie ich verpassen willst…


Sobald du zufrieden bist mit dem neuen Glanz deines Silbers, kannst du die Salzlösung abgiessen und die Aluminiumfolie, welche nun eine Oxidationsschicht trägt, in der Alusammelstelle entsorgen.
Reduktion von Silber
Im Abschnitt “Oxidation von Silber” habe ich schon erklärt, warum das Silber schwarz angelaufen ist. Im Experiment hat das Silber von einem Moment auf den anderen wieder zu seinem Glanz zurückgefunden. Selbstverständlich kommt hier noch die Erklärung, was dabei passiert ist.
Beim Oxidieren ist das Silber, nun ja, oxidiert. Das heisst, es hat Elektronen abgegeben (und zwar dem Sauerstoff) und sich mit dem Schwefel verbunden. Soll dieses sogenannte Silbersulfid Ag2S wieder zu Silber zurückreagieren, muss es nun reduziert werden. Es soll die Elektronen wieder aufnehmen, um dabei die Verbindung zum Schwefel aufzulösen.
Dazu lassen wir es mit dem Aluminium reagieren. Das Aluminium oxidiert, indem es den Silberatomen im Silbersulfid Elektronen abgibt. Dabei reduziert dieses wieder zu Silber, während sich der Schwefel nun mit dem Aluminium zu Aluminiumsulfid verbindet. Dass dabei das Aluminium oxidiert, ist daran zu erkennen, dass nun dieses schwarz anläuft.
Redox-Reaktion
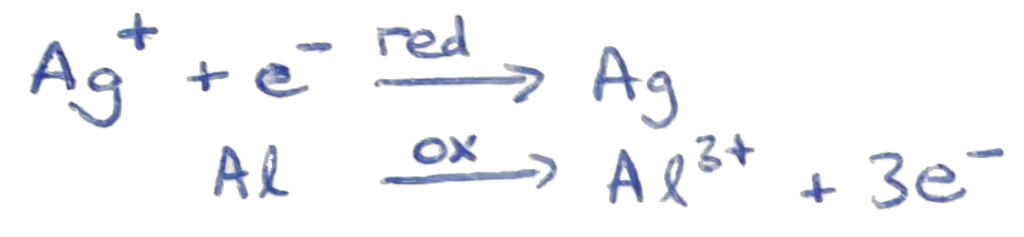
Die ganze Reaktion des Schwefelsulfids mit dem Aluminium

Das Wasser und das Salz haben an der Reaktion keine direkte Beteiligung. Die Elektronenübertragung passiert aber in einer Lösung (Wasser) schneller als in der Luft. Befinden sich in der Lösung Ionen (=geladene Atome), geht es noch deutlich schneller; die einzelnen Teilchen von gelöstem Salz sind Ionen.
Weil bei diesem Reinigungsprozess nur den Silberatomen seine Elektronen wieder zurückgegeben wurden, um seine die Verbindung zum Schwefel aufzulösen, konnte das Silber bleiben, wo es war. Es gibt somit keinen Materialverlust. Zudem ist das Experiment einfach und schnell durchzuführen, ungefährlich und faszinierend. Alles gute Gründe, sein Silber das nächste Mal so zu reinigen!

6 Replies to “Silber reinigen”
Cool! Auch wenn ich gerade kein Silber zu reinigen habe, würde ich gerne das Experiment durchführen =)
Wenn der Unterricht in der Schule immer so praxisorientiert und praktisch wäre, hätte ich die Redox vielleicht schon früher so faszinierend gefunden … ? 😉
Liebe Marisa
Das freut mich, dass du die Ausführungen faszinierend findest! Und wenn schon in der Schule nicht, dann wenigstens jetzt 😉
Liebe Nella, ja das ist wirklich sehr faszinierend! Wenn ich das nächste mal ein silbernes Schmuckstück zu reinigen habe, werde ich Deine Methode berücksichtigen!
Vielen Dank für den wertvollen Tipp!
…noch eine Frage: ich muss die Pfanne für diesen Vorgang NICHT erhitzen?
Liebe Jasmin
Da hast du natürlich Recht! Das Wasser muss erhitzt werden, sonst bräuchte man ja nicht unbedingt eine Pfanne… In heissem Wasser ist die Teilchenbewegung gegenüber kaltem Wasser deutlich erhöht und ermöglicht erst, dass die Reaktion schnell stattfinden kann. Ich habe die Anleitung noch um diesen verloren gegangenen Punkt ergänzt.
Wenn du also mal oxidierte Silberware zu reinigen hast, sollte das Experiment mit dieser korrigierten Anleitung klappen.
Ah, sehr gut! Vielen Dank für dieses nicht unwichtige Detail..!
Jasmin